原子结构
我们通过原子光谱研究原子结构。光谱是按照一定能量次序排列的光带,可见光光谱则是可以被人眼观察的光带。
能量的量子化
氢原子光谱实验
如下图所示,对氢气放电管通电,氢气解离为气态氢原子,发出紫光,透过棱镜得到氢原子光谱。
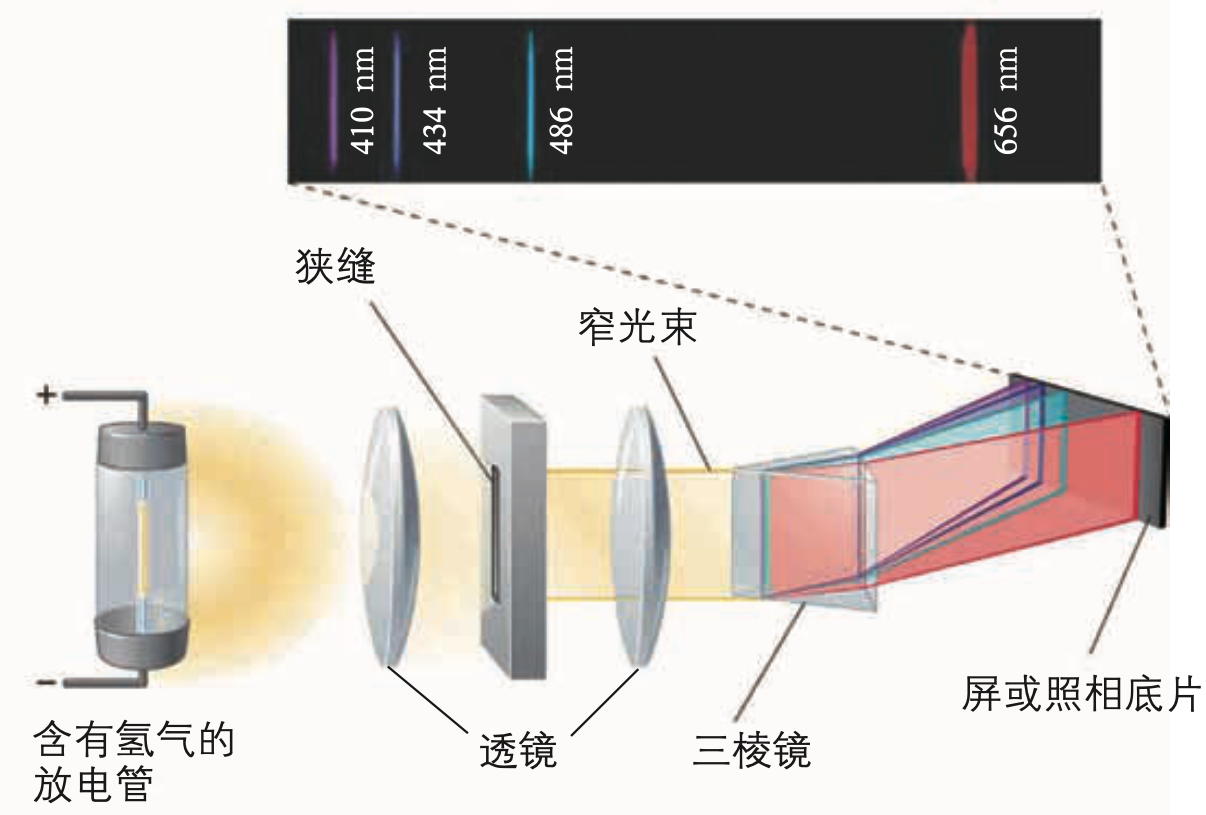
若原子中高速运动的电子运动类似宏观物体,则应当自动且连续地辐射能量,最终坍塌至原子核上。那么,原子的光谱应当是连续光谱,而不是具有特定波长谱线的线状光谱。光谱提示原子核外电子的位置和能量是不连续的。
玻尔(Niels Bohr)据此提出的核外电子分层排布之原子结构模型认为:
- 原子中的电子在半径确定的圆周轨道(orbit)上绕原子核运动,且不辐射能量
- 不同轨道上运动的电子具有不同的、不连续的能量,即能量的量子化。轨道能量依次升高,处于能量最低轨道的电子称为基态;能量高于基态能量的状态称为激发态。
- 电子只在跃迁时辐射或吸收能量。光谱便是电子辐射或吸收能量之光的表现形式。
但是,该模型不能解释更复杂的光谱现象:某些条件(如钠原子光谱或外加磁场)下会产生多条谱线,且用光分辨光谱仪可见氢原子光谱也有两条靠的很近的谱线。
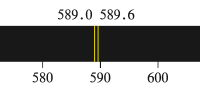
显然,上述模型未能描述该量子化现象。线状光谱的产生是电子在不同的、能量量子化状态间跃迁所致,因此,根据该现象,可推测相同「轨道」上的不同电子也存在能量差异。
现代化学使用量子力学理论作为理论基础,使用量子数
原子轨道
我们用原子轨道(atomic orbital)描述原子中单个电子的空间运动状态。此处的「轨道」被赋予新的含义。电子层为  同一原子轨道上有两种电子自旋状态,表示为「
同一原子轨道上有两种电子自旋状态,表示为「
霓虹灯便是灯管中充入不同的气体,能被高电压激发出不同颜色的光。灯管通电后,其中的原子在电场作用下吸收能量,激发到能量较高的轨道,并很快以光的形式辐射能量并跃迁回能量较低的轨道。
原子轨道在量子力学中用波函数表示。
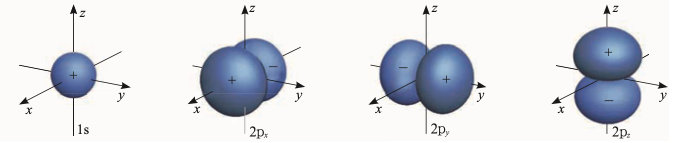
由此可知,量子力学中的轨道(orbital)不同于玻尔轨道(orbit),并非经典意义上的固定轨迹。
基态原子核外电子排布
根据光谱学事实,我们发现一个原子轨道中最多容纳两个电子,且这两个电子自旋状态不同。对于基态原子,核外电子在能量相同的原子轨道上排布时,将尽可能分占不同的原子轨道且自旋状态相同。在不违背上述前提下,核外电子在各个原子轨道上的排布方式应使整个原子体系的能量最低。另外,能量相同的原子轨道在全充满(如 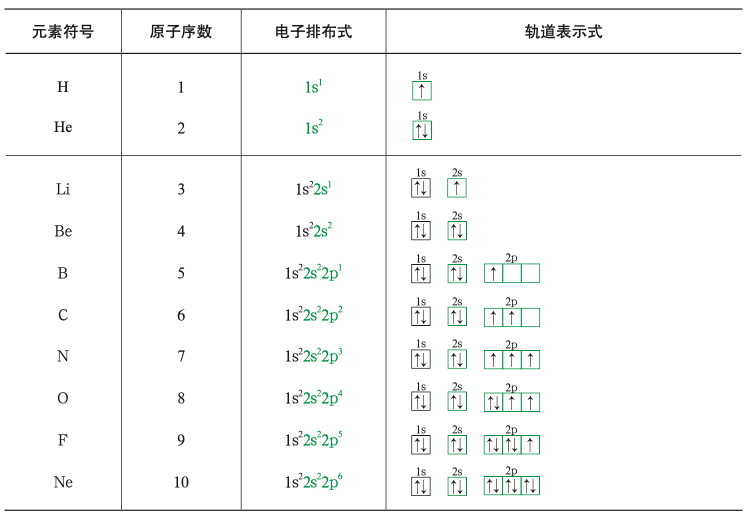
构造原理
随着原子序数递增,基态原子的「外层电子」按照「构造原理」的顺序(
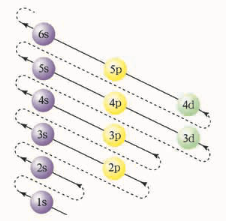
以上仅作为基态原子外层电子在原子轨道上排布的规律,并不代表各原子轨道的能级高低顺序。对于
与元素周期表的联系
周期的划分
根据光谱学事实,鲍林提出多电子原子的原子轨道近似能级图。
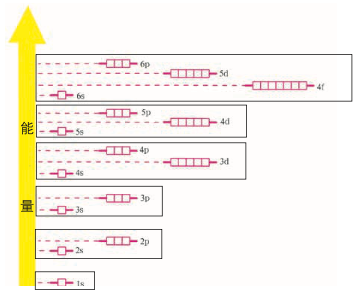
图中将能量相近的原子轨道归为一组,得到以下能级组:
- ···
所得能级组按照能量升序与元素周期表中的周期对应。一个能级组最多能容纳的电子数等于对应周期包含的元素种数。通常只有最外能级组的电子——价电子(valence electrons)才有可能参与化学反应。元素性质与原子的价电子数目密切相关。